GIMBE lancia l’allarme: “In Italia disponibili entro marzo solo 10 milioni di dosi”
“Al momento è possibile solo fare previsioni di massima rispetto al raggiungimento di una copertura vaccinale del 60-70% della popolazione”, dichiara il presidente della Fondazione GIMBE, Nino Cartabellotta.
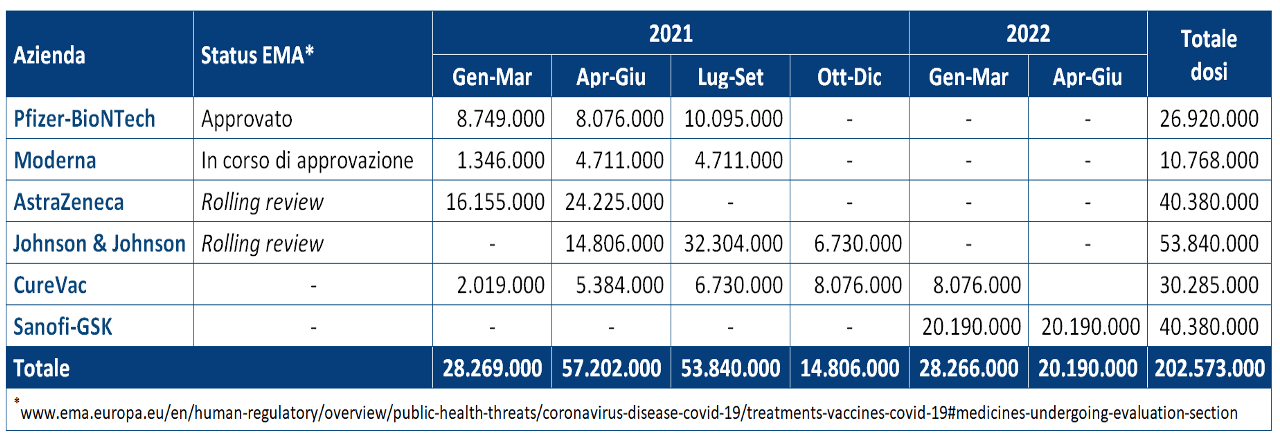
Vero è che il piano strategico del Ministero della Salute per la Vaccinazione anti-SARS-CoV-2/COVID-19 riporta oltre 202 milioni di dosi potenzialmente disponibili (pari a 101 milioni di cicli vaccinali completi).
Ma prima che gli accordi preliminari di acquisto si concretizzino in forniture, bisognerà aspettare il completamento degli studi clinici in corso, e la submission della documentazione completa all’Agenzia europea per i medicinali (EMA) da parte delle aziende produttrici. Solo a questo punto si procederà con la cosiddetta approvazione condizionata, cioè l’autorizzazione in condizioni di emergenza per la valutazione di efficacia e sicurezza.
Ma qual è lo stato di approvazione dei vaccini messi a punto dalle varie case farmaceutiche?
Le dosi certe sono poco più di 10 milioni disponibili entro marzo 2021 e 22,8 milioni entro giugno 2021: quelle del vaccino Pfizer-BioNTech, approvato dall’EMA il 21 dicembre, e quelle di Moderna che dovrebbe avere il via libera il prossimo 6 gennaio.
I vaccini di AstraZeneca e Johnson & Johnson sono in fase di rolling review, ossia di revisione ciclica. Cosa vuol dire?
La rolling review è uno strumento utilizzato dalle autorità regolatorie per accelerare la valutazione di farmaci o vaccini sperimentali potenzialmente promettenti durante un’emergenza sanitaria. Se in circostanze normali, tutti i dati sull’efficacia, la sicurezza e la qualità di un vaccino in fase di sperimentazione devono essere presentati contestualmente all’inizio di una procedura di richiesta di autorizzazione all’immissione in commercio, nel caso della rolling review l’autorità esaminerà i dati di volta in volta, non appena si renderanno disponibili. In questo modo può decidere più rapidamente se il vaccino va autorizzato o meno.
Una nota importante: nessuna delle due aziende ha ancora effettuato la submission dei dati completi per l’approvazione condizionata.
CureVac ha annunciato il 14 dicembre l’arruolamento del primo paziente nello studio di fase 3.
E cioè? La sperimentazione clinica sull’uomo si realizza in 3 fasi. La prima prevede la somministrazione del vaccino a un numero ridotto di soggetti per valutarne tollerabilità e sicurezza. Se la fase 1 ha mostrato risultati positivi, il vaccino viene somministrato a un numero maggiore di persone per valutare la risposta immunitaria, la tollerabilità, la sicurezza e quindi definire dosi e protocolli di somministrazione più adeguati. Infine, se anche la fase 2 ha mostrato risultati soddisfacenti, il vaccino viene somministrato a un numero elevato di persone per valutarne la reale funzione preventiva. Quando tutte le fasi hanno dato esito positivo, il vaccino viene registrato e si procede alla produzione e distribuzione su larga scala.
Sanofi-GSK ha già comunicato lo slittamento della consegna delle dosi al 2022.
Su tutto risalta poi l’incognita della variante UK, per cui sapremo solo all’inizio del 2021 se i vaccini a disposizioni saranno efficaci o meno.
Quantità potenziale di dosi disponibili secondo gli accordi preliminari di acquisto
st
Sono una giornalista con il pallino dell’ambiente e mi piace pensare che l’informazione onesta possa risvegliarci da questa anestesia collettiva che permette a mafiosi e faccendieri di arricchirsi sulle spalle del territorio e della salute dei cittadini.